Percée sur le front de la production de cellules rétiniennes in vitro

Un groupe de l’Institut de la Vision a réussi une première mondiale : isoler et multiplier des progéniteurs rétiniens, ces cellules qui ont la capacité de se différencier soit en cellules de l’épithélium rétinien pigmentaire, soit en tous les types de neurones de la rétine. Cette méthode innovante va accélérer la recherche et permettre de jeter un pont entre le fondamental et la clinique. Explications avec le Dr. Sacha Reichman, responsable du groupe de recherche à l’origine de cette avancée.
Parce qu’ils sont capables de produire tous les types cellulaires de la rétine, les progéniteurs rétiniens ont un énorme potentiel comme outil en recherche fondamentale, pharmacologique et clinique. Mais, jusque très récemment, les tentatives pour les cultiver étaient systématiquement des échecs.

Dr. Sacha Reichman, ingénieur de recherche et chef de groupe dans l’équipe « Développement et régénération de la rétine : apport des cellules souches pluripotentes » à l’Institut de la Vision.
À l'origine, il y a les organoïdes
Tout commence avec la mise au point par Sacha Reichman, alors en post-doctorat, il y a plus de 12 ans, d’un protocole qui permet d’obtenir des minirétines comme modèles in vitro à partir de cellules souches pluripotentes humaines (voir article "Les organoïdes, supports de thérapie pour la rétine"). Ces modèles, appelés organoïdes rétiniens, sont obtenus quasi simultanément par trois équipes dans le monde : au Japon, aux Etats-Unis et en France, par l’équipe d’Olivier Goureau à l’Institut de la Vision. « C’est vraiment apparu en même temps ! C’était incroyable de voir les publications sortir comme ça des quatre coins du monde ! » se souvient Sacha Reichman, qui reprend : « Notre protocole est le plus simple. Il ne demande que des changements successifs de milieu de culture. Mais il implique de bien connaître sa biologie du développement, pour choisir les bons facteurs de cultures ».

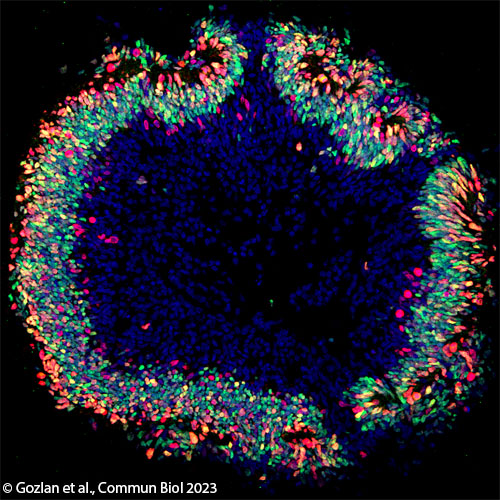
© Sacha Reichman. Institut de la Vision
Les structures tridimensionnelles qu’ils obtiennent s’autoorganisent en minirétines qui récapitulent fidèlement le développement de la rétine. Ce qui veut dire que les cellules souches pluripotentes initiales se différencient progressivement en organoïdes ne contenant au départ que des cellules multipotentes, les progéniteurs rétiniens. Ceux-ci se différencient à leur tour, jusqu’à donner les différentes cellules de la rétine, au fur et à mesure de la maturation de l’organoïde. En dissociant les organoïdes il est possible d’obtenir les différents types de neurones rétiniens utilisables en recherche. La technique est très intensive en main d’œuvre et ne permet pas de multiplier de façon importante le nombre de cellules produites.
Un cocktail pour préserver la multipotence
Puisqu’il semble impossible de multiplier directement les neurones, le groupe s’intéresse au type cellulaire précédent dans la chaîne de différenciation, le progéniteur rétinien. Mais tous les essais pour les cultiver se sont conclus par des échecs : si ce progéniteur est effectivement capable de se multiplier in vitro, il perd sa capacité de différenciation et donc sa multipotence. Pourtant ce n’est pas le cas des cellules souches pluripotentes, capables de se différencier en encore plus de types cellulaires. Sacha Reichman a alors l’intuition qu’un petit nombre de molécules bien choisies doit pouvoir résoudre ce problème et sélectionne même, dès 2012, trois candidates.
Dix ans plus tard, et deux molécules de plus, le protocole qu’il avait commencé à rédiger à l’époque a porté ses fruits, et permet de maintenir la multipotence des progéniteurs rétiniens in vitro. Et par la possibilité de les congeler, il est possible d’obtenir jusqu’à 10 fois plus de neurones rétiniens, en quatre fois moins de temps que tout ce qui avait été mis au point avant. Pour déterminer le cocktail de molécules idéal, « j’ai lu énormément de publications scientifiques sur le sujet. Ce que j’y ai sélectionné, parfois ce sont de toutes petites choses, des détails, mais qui éclairaient toute ma problématique. La recherche pour moi, c’est un peu comme des grains de sable sur la plage. Il faut beaucoup de grains de sable pour faire une plage, mais sans eux, il n’y a pas de plage. C’est grâce aux chercheurs précédents que j’ai pu faire mon petit grain de sable et à son tour il aidera d’autres chercheurs à faire avancer la connaissance » s’enthousiasme Sacha Reichman.

© Sacha Reichman. Institut de la Vision
Des applications pléthoriques
Une fois le protocole de maintien en culture établi, il a «suffi» de dissocier les organoïdes à un stade correspondant aux rétines embryonnaires précoces pour obtenir des progéniteurs rétiniens. La méthode mise au point par le groupe de Sacha Reichman, et brevetée, rend possible de les maintenir en culture, de les multiplier par un facteur 50, de les congeler et décongeler, sans qu’ils perdent leur capacité à se développer en différents types cellulaires de la rétine. Leurs utilisations, nombreuses, vont de l’étude de la rétinogénèse à la modélisation de pathologies rétiniennes rares ou chroniques en passant par la thérapie génique. Avec le bon milieu de culture, il est possible d’amener en deux semaines ces progéniteurs rétiniens à se différencier à 90% en précurseurs de photorécepteurs, ce qui permet d’obtenir des dizaines de millions de ces cellules précieuses. Celles-ci peuvent ensuite être utilisées en thérapie cellulaire, pour des essais de transplantation, mais aussi comme modèle pour mieux comprendre les pathologies dégénératives des photorécepteurs lorsqu’ils sont directement dérivés des patients.
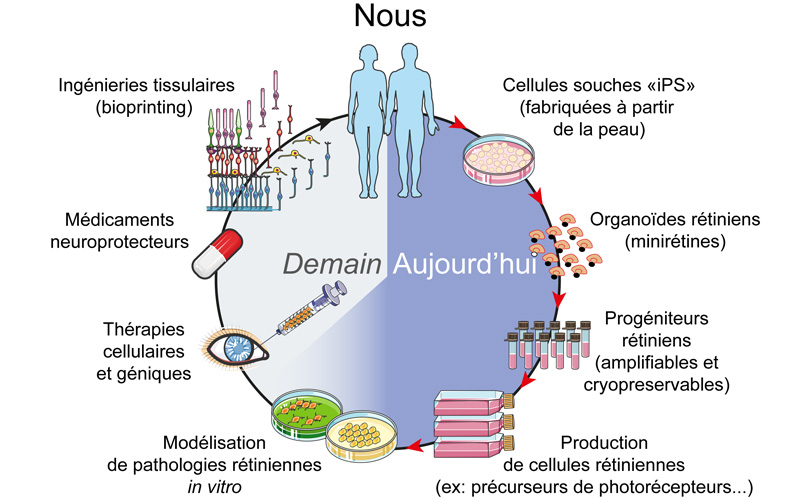

© Sacha Reichman
Un potentiel époustouflant pour le criblage de molécules
Sacha Reichman, lui, s’en sert pour tester l’effet de milliers de molécules à potentiel thérapeutique. Une des premières listes de molécules à laquelle il s’est intéressé est celle des composés présents dans les pharmacies approuvées par l’EMA et la FDA, les administrations européenne et américaine qui autorisent la commercialisation des médicaments. « Cela nous permet de voir si des molécules actives, déjà commercialisées, peuvent être des candidates crédibles pour soigner d’autres affections que celle pour laquelle elles ont été mises sur le marché. L’intérêt c’est que cela permet d’aller très vite en clinique car on connaît déjà la toxicité, les posologies et doses maximales à ne pas dépasser… », explique-t-il. L’objectif ensuite est de balayer beaucoup plus large en testant l’effet sur les photorécepteurs de composés qui couvrent la majorité des structures chimiques impliquées dans les différentes classes de molécules actives. « Et si nous trouvons des molécules protectrices, antidégénératives, pour les photorécepteurs, il est probable que cela ait un impact pour ceux d’entre nous qui les transplantent. C’est là qu’on voit la complémentarité de notre équipe », mentionne Sacha Reichman.
Au-delà des simples photorécepteurs, l’équipe maintient à l’heure actuelle des cultures pures de quatre types cellulaires rétiniens humains, qui sont disponibles pour la recherche académique. « Avoir ces cellules à disposition c’est aussi un gain de temps formidable pour l’enseignement, pour les étudiants. Un stagiaire de master, qui ne reste que 2 à 6 mois au laboratoire, peut ainsi commencer directement à expérimenter et obtenir rapidement des résultats. Avant, il mettait déjà deux mois à obtenir des organoïdes à dissocier » précise Le Dr. Sacha Reichman, qui souligne l’importance qu’il porte à l’enseignement.
Cette technologie de multiplication des progéniteurs rétiniens, fruit de la recherche d’excellence menée au 17 rue Moreau, devrait s’étendre bien au-delà des murs de l’Institut de la Vision. Elle présente en effet un intérêt pour l’ensemble de la communauté ophtalmologique travaillant sur des approches de neuroprotection ou de médecine régénérative.
Soutenez la recherche , soutenez l'Institut de la Vision >

Propos recueillis par Aline Aurias
À lire aussi

13 avancées majeures à l'Institut de la Vision
Si le temps de la recherche paraît souvent très long, et tout particulièrement pour les patients atteints de pathologies ne disposant d'aucun traitement, la recherche sur les maladies de la vision a

La dégénérescence maculaire liée à l'âge : DMLA

Les troubles de la vision et les maladies des yeux de A à Z
Douleur oculaire, une prise en charge unique au CHNO des Quinze-Vingts
La sécheresse oculaire est l’un des premiers motifs de consultation dans les cabinets d’ophtalmologie&nbs








